Таблица
Менделеева

Плутоний, элемент с порядковым номером 94, открыт Гленом Сиборгом (Glenn Seaborg), Эдвином Макмилланом (Edwin McMillan), Кеннеди (Kennedy), и Артуром Уолхом (Arthur Wahl) в 1940 году в Беркли при бомбардировки мишени из урана дейтронами из шестидесятидюймового циклотрона. В мае 1940 свойства плутония были предсказаны Льюисом Тернером (Louis Turner).
В декабре 1940 года был открыт изотоп плутония Pu-238, с периодом полураспада
Плутоний имеет четыре валентности, III-VI. Хорошо растворяется только в очень кислых средах, таких как азотная или соляная кислоты, так же хорошо растворяется в иодистоводородной и хлорной кислотах. Плутониевые соли легко гидролизируются при контакте с нейтральными или щелочными растворами, создавая нерастворимую гидроокись плутония. Концентрированные растворы плутония нестабильны, в следствии радиолитического разложения, ведущего к выпадению осадка.
Вследствии своей радиоактивности, плутоний теплый на ощупь. Большой кусок плутония в термоизолированной оболочке разогревается до температуры, превышающей температуру кипения воды. 
Основные физические свойства плутония:
Температура плавления: 641 °C;
Температура кипения: 3232 °C;
Плотность: 19.84 (в альфа-фазе).
Плутоний имеет множество специфических свойств. Он обладает самой низкой теплопроводностью изо всех металлов, самой низкой электропроводностью, за исключением марганца (по другим данным все же самой низкой из всех металлов). В своей жидкой фазе это самый вязкий металл.
Плутоний (элемент)
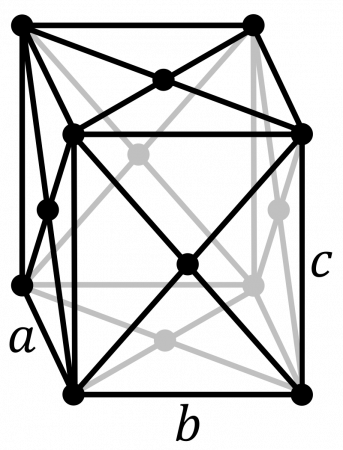
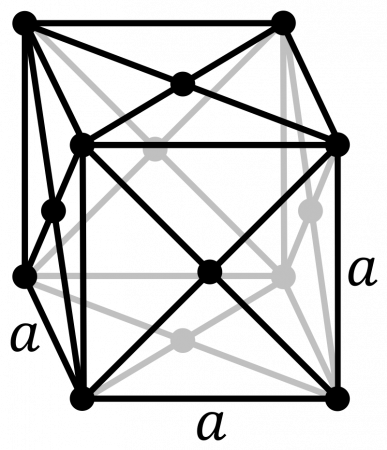
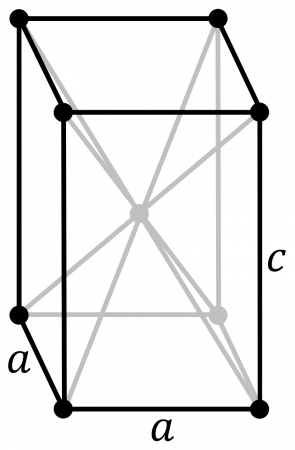
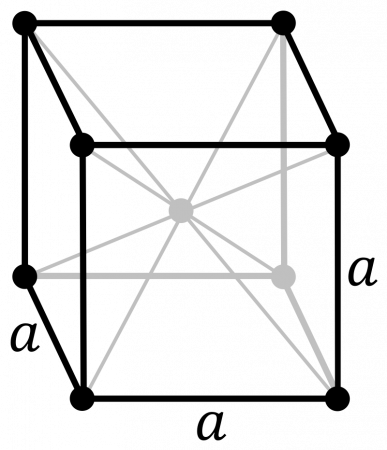
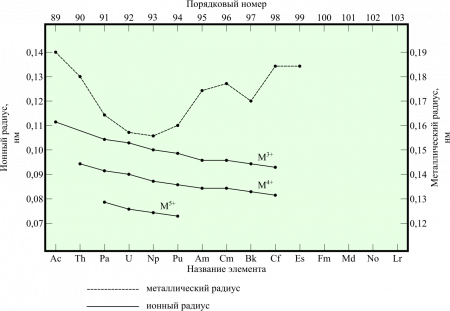
В таблице справа приведены основные свойства α-Pu — основной аллотропной модификации плутония при комнатной температуре и нормальном давлении.
Содержание
История
Изотоп плутония 238 Pu впервые искусственно получен 23.02.1941 года группой американских ученых во главе с Г. Сиборгом путем облучения ядер урана дейтронами. Примечательно, что только после искусственного получения плутоний был обнаружен в природе: в ничтожно малых количествах 239 Pu обычно содержится в урановых рудах как продукт радиоактивного превращения урана.
Нахождение в природе
В урановых рудах в результате захвата нейтронов (например, нейтронов из космического излучения) ядрами урана образуется нептуний ( 239 Np), продуктом β-распада которого и является природный плутоний-239. Однако плутоний образуется в таких микроскопических количествах (0,4—15 частей Pu на 10 12 частей U), что о его добыче из урановых руд не может быть и речи.
Происхождение названия
Физические свойства
Этот изотоп используется почти исключительно в РИТЭГ космического назначения, например, на всех аппаратах, улетавших дальше орбиты Марса.
Эти три изотопа серьёзного промышленного значения не имеют, но получаются, как побочные продукты, при получении энергии в ядерных реакторах на уране, путём последовательного захвата нескольких нейтронов ядрами урана-238. Изотоп 242 по ядерным свойствам наиболее похож на уран-238. Америций-241, получавшийся при распаде изотопа 241, использовался в детекторах дыма.
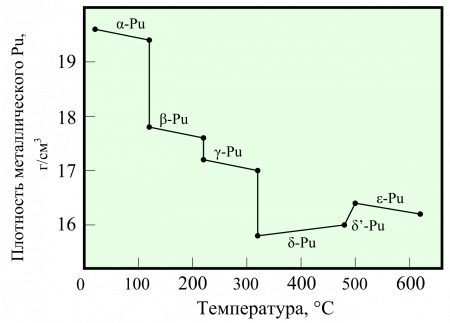
Плутоний интересен тем, что от температуры затвердевания до комнатной претерпевает шесть фазовых переходов, больше, чем любой другой химический элемент. При последнем плотность увеличивается скачком на 11%, в результате, отливки из плутония растрескиваются. Стабильной при комнатной температуре является альфа-фаза, характеристики которой и приведены в таблице. Для применения более удобной является дельта-фаза, имеющая меньшую плотность, и кубическую объёмно-центрированную решётку. Плутоний в дельта-фазе весьма пластичен, в то время, как альфа-фаза хрупкая. Для стабилизации плутония в дельта-фазе применяется легирование трёхвалентными металлами (в первых ядерных зарядах использовался галлий).
Применение
Биологическая роль
Плутоний высокотоксичен; ПДК для 239 Pu в открытых водоемах и воздухе рабочих помещений составляет соответственно 81,4 и 3,3*10 −5 Бк/л. Большинство изотопов плутония обладают высокой величиной плотности ионизации и малой длиной пробега частиц, поэтому его токсичность обусловлена не столько его химическими свойствами (вероятно, в этом отношении плутоний токсичен не более, чем другие тяжелые металлы), сколько ионизирующим действием на окружающие ткани организма. Плутоний относится к группе элементов с особо высокой радиотоксичностью. В организме плутоний производит большие необратимые изменения в скелете, печени, селезенке, почках, вызывает рак. Максимально допустимое содержание плутония в организме не должно превышать десятых долей микрограмма.
Плутоний Pu
Плутоний в таблице менделеева занимает 94 место, в 9 периоде.
| Символ | Pu |
| Номер | 94 |
| Атомный вес | Нестабилен |
| Латинское название | Plutonium |
| Русское название | Плутоний |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема плутония
Pu: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1
Короткая запись:
Pu: [Xe]6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1
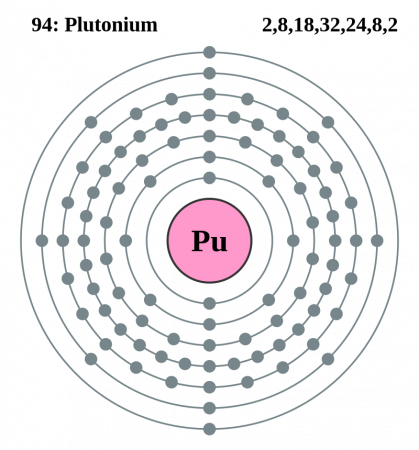
Порядок заполнения оболочек атома плутония (Pu) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Плутоний имеет 94 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
2 электрона на 6s-подуровне
14 электронов на 4f-подуровне
10 электронов на 5d-подуровне
6 электронов на 6p-подуровне
2 электрона на 7s-подуровне
5 электронов на 5f-подуровне
1 электрон на 6d-подуровне
Степень окисления плутония
Атомы плутония в соединениях имеют степени окисления 7, 6, 5, 4, 3, 2.
Ионы плутония
Валентность Pu
Атомы плутония в соединениях проявляют валентность VII, VI, V, IV, III, II.
Валентность плутония характеризует способность атома Pu к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Pu
Видео заполнения электронной конфигурации (gif):
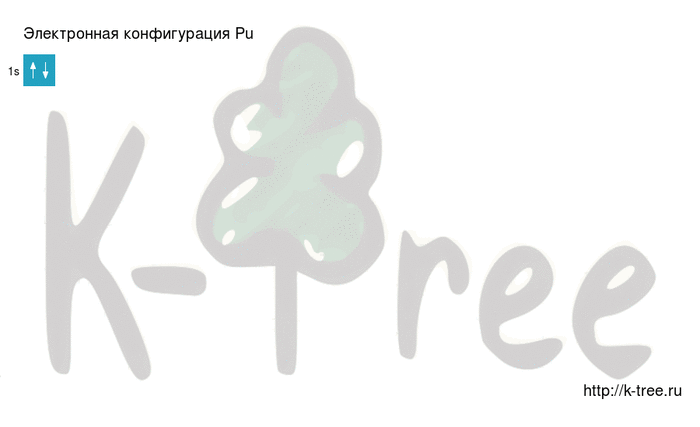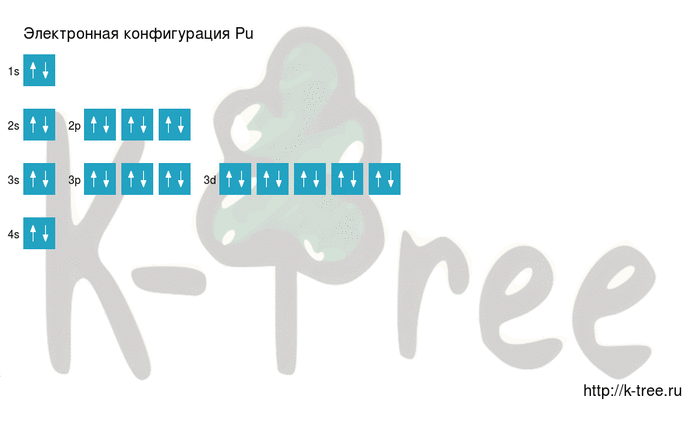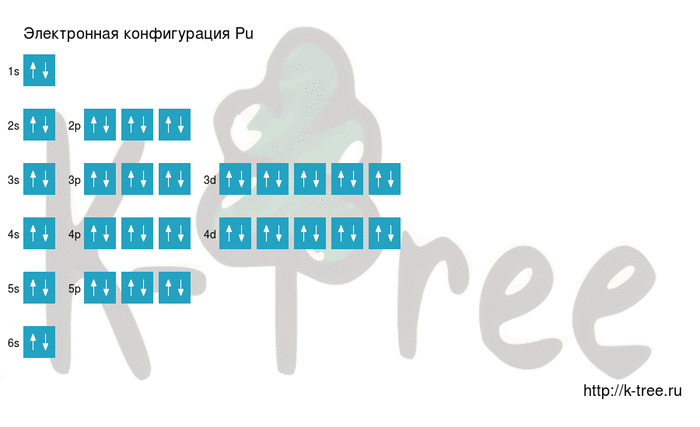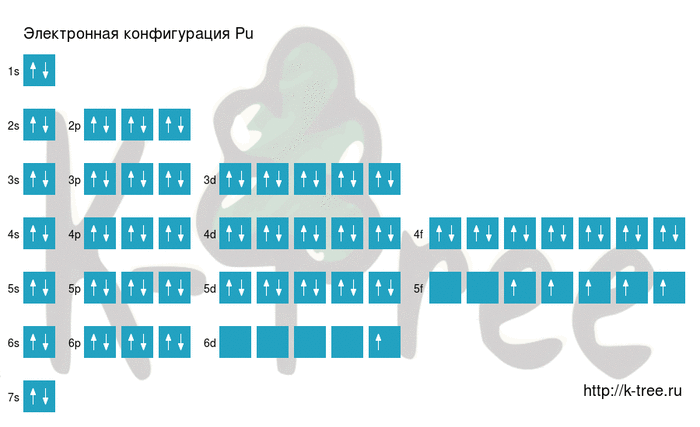
Результат: 
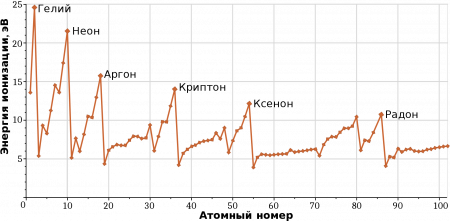
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Плутоний, свойства атома, химические и физические свойства
Плутоний, свойства атома, химические и физические свойства.










244,0642 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 5f 6 6s 2 6p 6 7s 2
Плутоний — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 94. Расположен в 3-й группе (по старой классификации — побочной подгруппе третьей группы), седьмом периоде периодической системы. Относится к группе актиноидов.
Атом и молекула плутония. Формула плутония. Строение атома плутония:
Плутоний обозначается символом Pu.
Изотопы и модификации плутония:
Свойства плутония (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Плутоний |
| 102 | Прежнее название | |
| 103 | Латинское название | Plutonium |
| 104 | Английское название | Plutonium |
| 105 | Символ | Pu |
| 106 | Атомный номер (номер в таблице) | 94 |
| 107 | Тип | Металл |
| 108 | Группа | Актиноид. Переходный, радиоактивный металл. Трансурановый элемент |
| 109 | Открыт | Гленн Теодор Сиборг, Артур Валь, Джозеф Уильям Кеннеди и Эдвин Маттисон Макмиллан, США, май 1940 г. |
| 110 | Год открытия | 1940 г. |
| 111 | Внешний вид и пр. | Тяжёлый, хрупкий, радиоактивный металл серебристо-белого цвета. Тёплый на ощупь. Радиотоксичен |
| 112 | Происхождение | Получен путем синтеза |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 7 аллотропных модификаций:
– ζ-плутоний |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0 %. В земной коре встречается в следовых количествах |
| 120 | Содержание в морях и океанах (по массе) | 0 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0 % |
| 122 | Содержание в Солнце (по массе) | 0 % |
| 123 | Содержание в метеоритах (по массе) | 0 % |
| 124 | Содержание в организме человека (по массе) | 0 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 244,0642 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14
5s 2 5p 6 5d 10 5f 6 6s 2 6p 6 7s 2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O24 P8 Q2 R0
|
| 204 | Радиус атома (вычисленный) | |
| 205 | Эмпирический радиус атома* | 151 |
| 206 | Ковалентный радиус* | 187пм |
| 207 | Радиус иона (кристаллический) | Pu 3+
16,63 г/см 3 (при температуре плавления 639,4 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 639,4 °C (912,5 K, 1182,9 °F) |
| 403 | Температура кипения* | 3228 °C (3505 K, 5842 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 2,82 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 333,5 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 35,5 Дж/(K·моль) |
| 411 | Молярный объём | 12,12 см³/моль |
| 412 | Теплопроводность | 6,74 Вт/(м·К) (при стандартных условиях ),
6,74 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-плутоний |
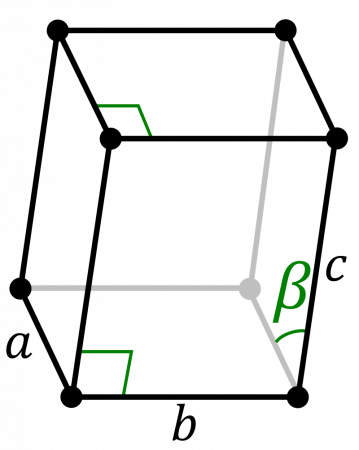
| 512 | Структура решётки | Моноклинная
|
| 513 | Параметры решётки | a = 6,183 Å, b = 4,822 Å, c = 10,963 Å, β = 101,8° |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 162 K |
| 516 | Название пространственной группы симметрии | P121/m1 |
| 517 | Номер пространственной группы симметрии | 11 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-07-5 |
205* Эмпирический радиус атома плутония согласно [1] и [3] составляет 159 пм и 162 пм соответственно.
206* Ковалентный радиус плутония согласно [1] составляет 187±1 пм.
401* Плотность всех аллотропных модификаций плутония согласно [3] варьируется от 15,9 г/см 3 до 19,86 г/см 3 (состояние вещества – твердое тело).
402* Температура плавления плутония согласно [3] и [4] составляет 639,7 °C (912 K, 1182 °F) и 640 °C (913,15 K, 1184 °F) соответственно.
403* Температура кипения плутония согласно [3] и [4] составляет 3235 °C (3507 K, 5855 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) плутония согласно [3] и [4] составляет 2,8 кДж/моль и 2,824 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) плутония согласно [3] и [4] составляет 343,5 кДж/моль и 351 кДж/моль соответственно.
410* Молярная теплоемкость плутония согласно [3] составляет 32,77 Дж/(K·моль).
Плутоний

(молярная масса)
Pu 4+ : 86 пм,
Pu 5+ : 74 пм,
Pu 6+ : 71 пм
Pu←Pu 3+ −2,0 В,
Pu←Pu 2+ −1,2 В
(первый электрон)
| P (Па) | 1 | 10 | 100 | 1000 | 10 000 | 100 000 |
| при T (К) | 1756 | 1953 | 2198 | 2511 | 2926 | 3499 |
b=4,822 Å
c=10,963 Å
β=101,8°
Плутоний (обозначается символом Pu; атомное число 94) — тяжёлый хрупкий высокотоксичный радиоактивный металл серебристо-белого цвета. В периодической таблице располагается в семействе актиноидов.
Для элемента характерны существенно отличающиеся от остальных элементов структурные и физико-химические свойства. Плутоний имеет семь аллотропных модификаций при определённых температурах и диапазонах давления: α, β, γ, δ, δ’, ε и ζ. Может принимать степени окисления от +2 до +7, основными считаются +4, +5, +6. Плотность варьируется от 19,8 (α-Pu) до 15,9 г/см³ (δ-Pu).
Стабильных изотопов не имеет. В природе в следовых количествах присутствуют самый долгоживущий изотоп из всех трансурановых элементов 244 Pu, его дочерний нуклид 240 Pu, а также 239 Pu и 238 Pu. В окружающей среде находится преимущественно в виде диоксида (PuO2), который в воде ещё менее растворим, чем песок (кварц). Нахождение элемента в природе настолько мало, что его добыча нецелесообразна.
Второй после нептуния (который был ошибочно «получен» в 1934 году группой Энрико Ферми; его первый изотоп 239 Np синтезирован и идентифицирован в мае 1940 года Эдвином Макмилланом и Филипом Абельсоном) искусственный элемент, полученный в микрограммовых количествах в конце 1940 г. в виде изотопа 238 Pu.
Первый искусственный химический элемент, производство которого началось в промышленных масштабах (в СССР с 1946 года в Челябинске-40 было создано несколько предприятий по производству оружейного урана и плутония). США, а затем и СССР были первыми странами, освоившими его получение. Для получения плутония применяется как обогащённый, так и природный уран. Общее количество плутония, хранящегося в мире во всевозможных формах, оценивалось в 2003 г. в 1239 т.
Сообщалось о закрытии последнего в мире ядерного реактора по производству оружейного плутония АДЭ-2, который проработал 46 лет и был остановлен в апреле 2010 г. в России, однако уже через месяц в Японии был запущен реактор «Мондзю» (разрешение на перезапуск было получено только в феврале 2010 года, а сам реактор был фактически запущен в тестовом режиме 6 мая; такой режим работы предполагался вплоть до 2013 года, однако 26 августа 2010 года на реакторе произошла новая авария — в реактор упала трёхтонная металлическая труба, повредившая сам реактор; общая остановка реакторов на японских АЭС после аварии на Фукусима-1 привела к тому, что реактор больше не запускали, в конце 2016 года японское правительство приняло решение об утилизации реактора Мондзю, планируется выгрузка топлива в 2022 и окончание работ по демонтажу в 2047).
В таблице справа приведены основные свойства для α-плутония. Данная аллотропическая модификация является основной для плутония при комнатной температуре и нормальном давлении.
Содержание
История
Открытие
Энрико Ферми вместе со своими сотрудниками в Университете Рима сообщил, что они обнаружили химический элемент с порядковым номером 94, в 1934 году. Ферми назвал этот элемент гесперием, сделав таким образом предположение о существовании трансурановых элементов и став их теоретическим первооткрывателем. Он придерживался этой позиции и в своей Нобелевской лекции в 1938 году, однако, узнав об открытии Отто Фришем и Фрицем Штрассманом деления ядра, был вынужден сделать в печатной версии, вышедшей в Стокгольме в 1939 году, примечание, указывающее на необходимость пересмотра «всей проблемы трансурановых элементов». Работа немецких учёных показала, что активность, обнаруженная Ферми в его экспериментах, была обусловлена именно делением, а не открытием трансурановых элементов, как он ранее полагал.

Открытие плутония группой сотрудников Калифорнийского университета в Беркли под руководством Г. Т. Сиборга было совершено с помощью 60-дюймового циклотрона. Первая бомбардировка октаоксида триурана-238 ( 238 U3O8) дейтронами, разогнанными в циклотроне до 14—22 МэВ и проходящими через алюминиевую фольгу толщиной 0,002 дюйма (50,8 мкм), была произведена 14 декабря 1940 года. Сравнивая образцы, полученные и выдержанные в течение 2,3 суток, с выделенной фракцией чистого нептуния, учёные обнаружили существенную разницу в их альфа-активностях и предположили, что её рост через 2 суток обусловлен влиянием нового элемента, являющегося дочерним по отношению к нептунию. Дальнейшие физические и химические исследования продолжались 2 месяца. В ночь с 23 на 24 февраля 1941 года был проведён решающий эксперимент по окислению предполагаемого элемента с помощью пероксиддисульфат-ионов и ионов серебра в качестве катализатора, который показал, что нептуний-238 спустя два дня претерпевает бета-минус-распад и образует химический элемент под номером 94 в следующей реакции:
238
92 U (d,2n) → 238
93 Np → (β − ) 238
94 Pu

Таким образом, существование нового химического элемента было подтверждено экспериментально Г. Т. Сиборгом, Э. М. Макмилланом, Дж. В. Кеннеди ( англ. ) и А. К. Валем благодаря изучению его первых химических свойств — возможностью обладать, по крайней мере, двумя степенями окисления.
Немного позднее было установлено, что этот изотоп является неделящимся (пороговым), а следовательно, неинтересным для дальнейших исследований в военных целях, так как пороговые ядра не могут служить основой цепной реакции деления. Поняв это, физики-ядерщики США направили свои усилия на получение делящегося изотопа-239 (который по расчётам должен был быть более мощным источником атомной энергии, чем уран-235). В марте 1941 года 1,2 кг чистейшей соли урана, замурованной в большой парафиновый блок, подвергли в циклотроне бомбардировке нейтронами. На протяжении двух суток длилась бомбардировка урановых ядер, в результате чего были получены приблизительно 0,5 мкг плутония-239. Появление нового элемента, как и было предсказано теорией, сопровождалось потоком альфа-частиц.
28 марта 1941 года проведённые эксперименты показали, что 239 Pu способен делиться под действием медленных нейтронов, с сечением, весьма значительно превышающим сечение для 235 U, причём нейтроны, полученные в процессе деления, пригодны для получения следующих актов ядерного деления, то есть позволяют рассчитывать на осуществление цепной ядерной реакции. С этого момента были начаты опыты по созданию плутониевой ядерной бомбы и строительства реакторов для его наработки. Первое чистое соединение элемента было получено в 1942 году, а первые весовые количества металлического плутония — в 1943 году.
В работе, отправленной на публикацию в журнал Physical Review в марте 1941 г., был описан метод получения и изучения элемента. Однако публикация этой работы была остановлена после того, как были получены данные, что новый элемент может быть использован в ядерной бомбе. Публикация работы произошла спустя год после Второй мировой войны из соображений безопасности и с некоторыми корректировками.
В Третьем рейхе исследователи атома также не оставались бездеятельными. В лаборатории Манфреда фон Ардена были разработаны методы получения 94-го элемента. В августе 1941 года физик Фриц Хоутерманс закончил свой секретный доклад «К вопросу о развязывании цепных ядерных реакций». В нём он указывал на теоретическую возможность изготовления в урановом «котле» нового взрывчатого вещества из природного урана.
Происхождение названия

В 1930 году была открыта новая планета, о существовании которой давно говорил Персиваль Ловелл — астроном, математик и автор фантастических очерков о жизни на Марсе. На основе многолетних наблюдений за движениями Урана и Нептуна он пришёл к заключению, что за Нептуном в Солнечной системе должна быть ещё одна, девятая планета, располагающаяся от Солнца в сорок раз дальше, чем Земля. Элементы орбиты новой планеты были им рассчитаны в 1915 году. Плутон был обнаружен на фотографических снимках, полученных 21, 23 и 29 января 1930 г. астрономом Клайдом Томбо в обсерватории Лоуэлла во Флагстаффе (США). Планета была открыта 18 февраля 1930 года. Название планете было дано одиннадцатилетней школьницей из Оксфорда Венецией Бёрни. В греческой мифологии Аид (в римской Плутон) является богом царства мёртвых.
Первое печатное упоминание термина плутоний датируется 21 марта 1942 года. Название 94-му химическому элементу было предложено Артуром Валем и Гленном Сиборгом. В 1948 году Эдвин Макмиллан предложил назвать 93-й химический элемент нептунием, так как планета Нептун — первая за Ураном. По аналогии в честь второй планеты за Ураном, Плутона, был назван плутоний. Открытие плутония произошло через 10 лет после открытия карликовой планеты (примерно такой же отрезок времени понадобился на открытие Урана и на именование 92-го химического элемента).
Первоначально Сиборг предложил назвать новый элемент «плутием», однако позже решил, что название «плутоний» звучит лучше. Для обозначения элемента он в шутку привёл две буквы «Pu» — это обозначение представилось ему наиболее приемлемым в периодической таблице. Также Сиборгом были предложены некоторые другие варианты названий, например, ультимий (англ. ultimium от лат. ultimus — последний), экстремий ( extremium от лат. extremus — крайний), из-за ошибочного в то время суждения, что плутоний станет последним химическим элементом в периодической таблице. Однако элемент назвали «плутоний» в честь последней планеты Солнечной системы.
Первые исследования
После нескольких месяцев первоначальных исследований химия плутония стала считаться похожей на химию урана. Дальнейшие исследования были продолжены в секретной металлургической лаборатории Чикагского университета. Благодаря Каннингему и Вернеру 18 августа 1942 года был выделен первый микрограмм чистого соединения плутония из 90 кг уранилнитрата, облученного нейтронами на циклотроне 10 сентября 1942 года — спустя месяц, на протяжении которого учёные увеличивали количество соединения — произошло взвешивание. Этот исторический образец весил 2,77 мкг и состоял из диоксида плутония; в настоящее время хранится в Лоуренсовском зале в Беркли. К концу 1942 года было накоплено 500 мкг соли элемента. Для более подробного изучения нового элемента в США было сформировано несколько групп:
В ходе исследований было установлено, что плутоний может находиться в степенях окисления от 3 до 6, и что более низшие степени окисления, как правило, более стабильны по сравнению с нептунием. Тогда же было установлено сходство химических свойств плутония и нептуния. В 1942 году неожиданным стало открытие Стэна Томсона, входящего в группу Гленна Сиборга, которое показало, что четырёхвалентный плутоний получается в бо́льших количествах при нахождении в кислом растворе в присутствии фосфата висмута (III) (BiPO4). В дальнейшем это привело к изучению и применению висмут-фосфатного метода экстракции плутония. В ноябре 1943 г. некоторые количества фторида плутония(III) (PuF3) были подвергнуты разделению для получения чистого образца элемента в виде нескольких микрограммов мелкодисперсного порошка. Впоследствии были получены образцы, которые можно было бы рассмотреть невооружённым глазом.

В СССР первые опыты по получению 239 Pu были начаты в 1943—1944 гг. под руководством академиков И. В. Курчатова и В. Г. Хлопина. В короткий срок в СССР были выполнены обширные исследования свойств плутония. В начале 1945 года на первом в Европе циклотроне, построенном в 1937 году в Радиевом институте, был получен первый советский образец плутония путём нейтронного облучения ядер урана. В городе Озёрск с 1945 года началось строительство первого промышленного ядерного реактора по производству плутония, первый объект ПО Маяк, пуск которого был осуществлён 19 июня 1948 года.
Производство в Манхэттенском проекте
Во время Второй мировой войны целью проекта являлось создание ядерной бомбы. Проект атомной программы (англ. atomic programm ), из которой образовался Манхэттенский проект, был одобрен и одновременно создан указом Президента США 9 октября 1941 года. Свою деятельность Манхэттенский проект начал 12 августа 1942 года. Тремя его основными направлениями являлись:


Вторым реактором, который позволил получать плутоний-239, был Графитовый реактор X-10. Он был введён в эксплуатацию 4 ноября 1943 года (строительство длилось 11 месяцев) в городе Оук-Ридж, в настоящее время он располагается на территории Оук-Риджской национальной лаборатории. Этот реактор был вторым в мире после Чикагской поленницы-1 и первым реактором, который был создан в продолжении Манхэттенского проекта. Реактор был первым шагом на пути к созданию более мощных ядерных реакторов (на территории Хэнфорда, Вашингтон), то есть он был экспериментальным. Окончание его работы наступило в 1963 г.; открыт для посещения с 1980-х годов и является одним из старейших ядерных реакторов в мире.

Первым промышленным ядерным реактором по производству 239 Pu является реактор B, расположенный в США. Строительство началось с июня 1943 г. и закончилось в сентябре 1944 г. Мощность реактора составила 250 МВт (в то время как у X-10 всего 1000 кВт). В качестве теплоносителя в этом реакторе впервые применялась вода. Реактор B (вместе с реактором D и реактором F — остальными двумя) позволил получить плутоний-239, который был впервые использован в испытании Тринити. Ядерные материалы, полученные на этом реакторе, были использованы в бомбе, сброшенной на Нагасаки 9 августа 1945 г. Построенный реактор был закрыт в феврале 1968 года и расположен в пустынном районе штата Вашингтон, недалеко от города Ричланд.
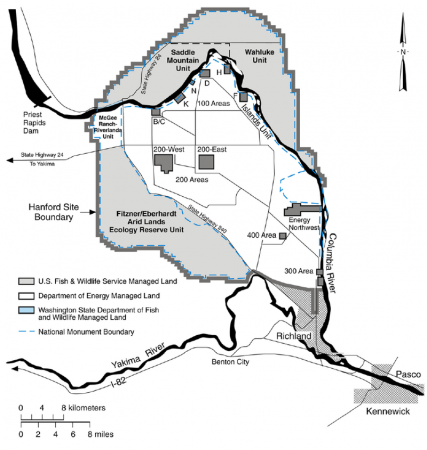
В 2004 г. в результате раскопок были обнаружены захоронения на территории Хэнфордского комплекса. В числе них был найден оружейный плутоний, который находился в стеклянном сосуде. Этот образец оружейного плутония оказался самым долгоживущим и был исследован Тихоокеанской национальной лабораторией. Результаты показали, что этот образец был создан на графитовом реакторе X-10 в 1944 году.
Тринити и Толстяк
Холодная война
Большие количества плутония были произведены во время Холодной войны США и СССР. Реакторы США, находящиеся в Savannah River Site (Северная Каролина) и Хэнфорде, во время войны произвели 103 т плутония, в то время как СССР произвел 170 т оружейного плутония. На сегодня около 20 т плутония в ядерной энергетике производится как побочный продукт ядерных реакций. На 1000 т плутония, находящегося в хранилищах, приходится 200 т плутония, извлечённого из ядерных реакторов. На 2007 год СИИПМ оценил мировое количество плутония в 500 т, который примерно одинаково разделён на оружейные и энергетические нужды.
Медицинские эксперименты
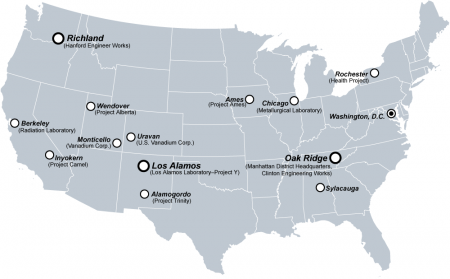
Восемнадцать испытаний плутония на людях были проведены без предварительного согласия испытуемых для того, чтобы выяснить, где и как концентрируется плутоний в человеческом организме, и выработать стандарты безопасности обращения с ним. Первые места, в которых проводились эксперименты в рамках Манхэттенского проекта, были: Хэнфорд, Беркли, Лос-Аламос, Чикаго, Оук-Ридж, Рочестер.
Свойства
Физические свойства
Плутоний, как и большинство металлов, имеет яркий серебристый цвет, похожий на никель или железо, но на воздухе окисляется, меняя свой цвет сначала на бронзовый, затем на синий цвет закалённого металла и после превращается в тусклый чёрный или зелёный цвета из-за образования рыхлого окисного покрытия. Также есть сообщения об образовании жёлтого и оливкового цвета оксидной плёнки. При комнатной температуре плутоний находится в α-форме — это наиболее распространённая для плутония аллотропная модификация. Данная структура примерно такая же жёсткая, как серый чугун, если она не легирована другими металлами, которые придадут сплаву пластичность и мягкость. В отличие от большинства металлов, он не является хорошим проводником тепла и электричества.
Плутоний имеет аномально низкую для металлов температуру плавления (примерно 640 °C) и необычно высокую температуру кипения (3235 °C). Свинец является более лёгким металлом, чем плутоний примерно в два раза (разница в плотности составляет 19,86 − 11,34 ≈ 8,52 г/см³).
—
—